DNA与蛋白质的相互作用作为表观遗传学中的一个重要领域,对理解基因表达调控、DNA复制与修复、表观遗传修饰(组蛋白修饰)及染色质结构等基本生命过程至关重要。
自1983年James Broach首次公布染色质免疫共沉淀(ChIP)技术以来,这一技术迅速成为了生物学研究中的一个重要工具。ChIP-seq(Chromatin Immunoprecipitation with highthroughput sequencing)结合了染色质免疫沉淀和高通量测序技术,通过甲醛交联、染色质处理、抗体富集、目标片段建库、测序和分析等过程,可以获得蛋白质-DNA相互作用的全局视图,一跃成为该领域研究的“金标准”技术。
传统的ChIP-seq存在操作技术难度大,细胞需求量大,背景噪音等问题,科研人员致力于开发新的技术来简化实验流程提高检测灵敏性和特异性。2019年,Steven Henikoff团队创新性地利用刀豆蛋白A(ConA)包被的磁珠吸附细胞,并用洋地黄皂苷在细胞膜上“打孔”, 在抗体引导下通过改良的pA-Tn5转座酶对目的蛋白附近的DNA 进行片段化并引入接头序列,然后PCR扩增获得测序文库,CUT&Tag(Cleavage Under Targets and Tagmentation)技术应运而生。同为研究DNA与蛋白质互作的高通量测序技术,到底哪个更胜一筹?
首先,我们对比下ChIP-seq 和 CUT&Tag的实验原理:作为捕捉蛋白质-DNA复合物的核心关键,两种技术都依赖于特异性抗体来识别并结合目标蛋白质并对最终捕获的DNA进行二代文库构建。但ChIP-seq的方式为通过甲醛交联,染色质片段化,免疫共沉淀和解交联纯化DNA构建小片段文库。而CUT&Tag则是抗体入核孵育后通过改造后的pA(/G)-Tn5转座体直接完成切割并保留建库接头,通过PCR扩增完成文库构建。

其次,ChIP-seq 和 CUT&Tag的实验过程也会有较大的差异。ChIP-seq前期交联,制备细胞核和片段化等流程需要的时间较久,且后续建库需要经历末端修复,接头连接,接头纯化,PCR扩增和文库纯化等步骤,所以整体的实验过程较复杂。CUT&Tag的主要过程在于样本制备较为简单,相较于ChIP-seq抗体孵育的时间也会有所缩短,且转座的过程中已加入测序的接头,后续仅需要经过一次PCR的扩增即可得到最终文库。但获得高质量的实验数据需都需要谨慎对待每步的操作。
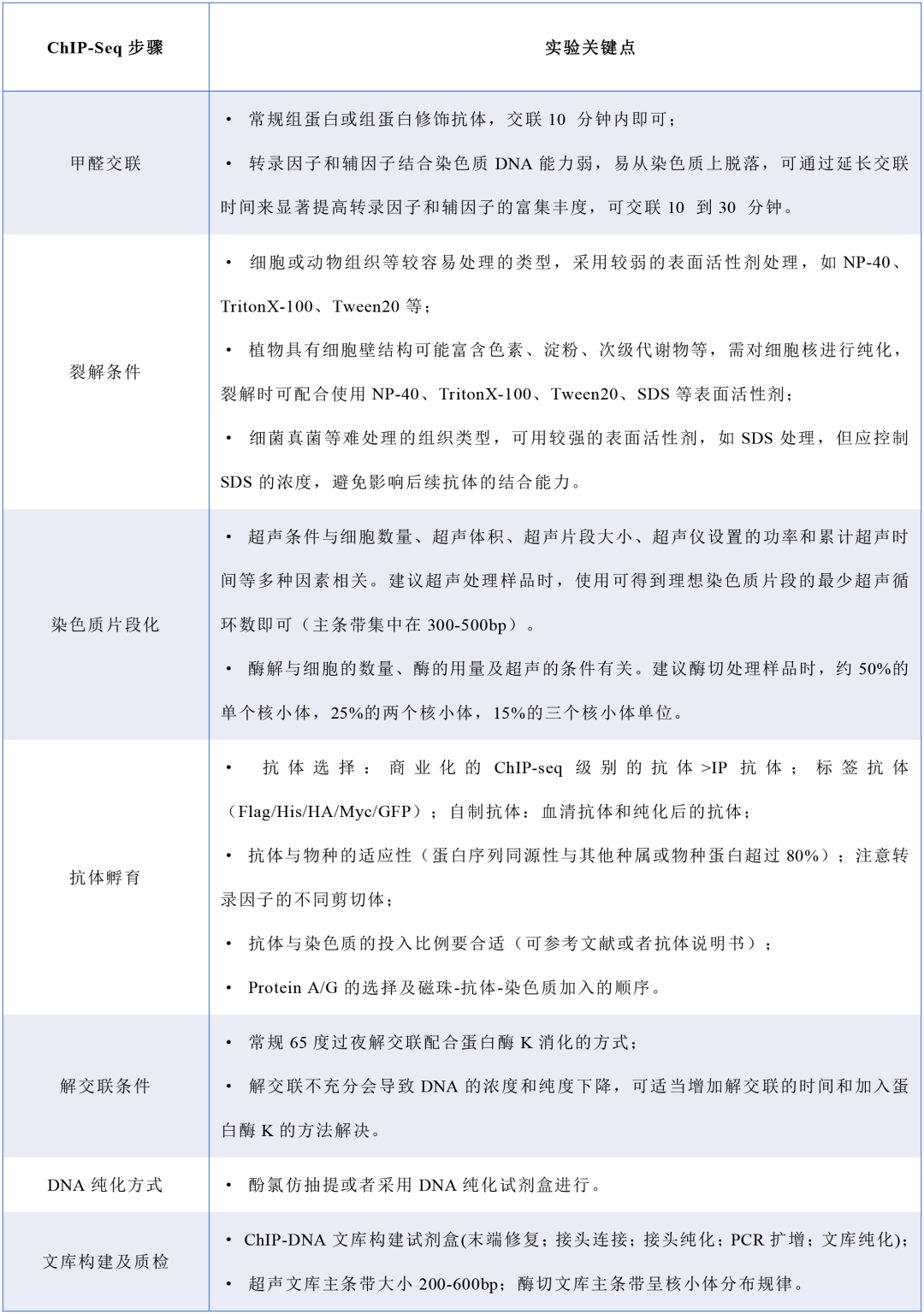

除了在这些实验流程中的区别外,从样本的适用性、实验的重复性、数据的信噪比等方面ChIP-seq 和 CUT&Tag也会有一些区别。由于实验流程的简便化且CUT&Tag采用转座酶法建库的原理,使得CUT&Tag可以兼容更低投入起始量,在一些胚胎细胞、原代细胞等量少且珍贵的样本类型中应用较为广泛。而ChIP-seq虽在低起始量上性能略差,但在物种和靶位点的兼容性上要优于CUT&Tag。ChIP-seq实验中会受到甲醛交联,超声打断及免疫沉淀效率的影响,整体的重复性和信噪比较CUT&Tag要低一些,为追求更高质量的分析结果,通常会采用较高的测序深度弥补实验中的缺陷。
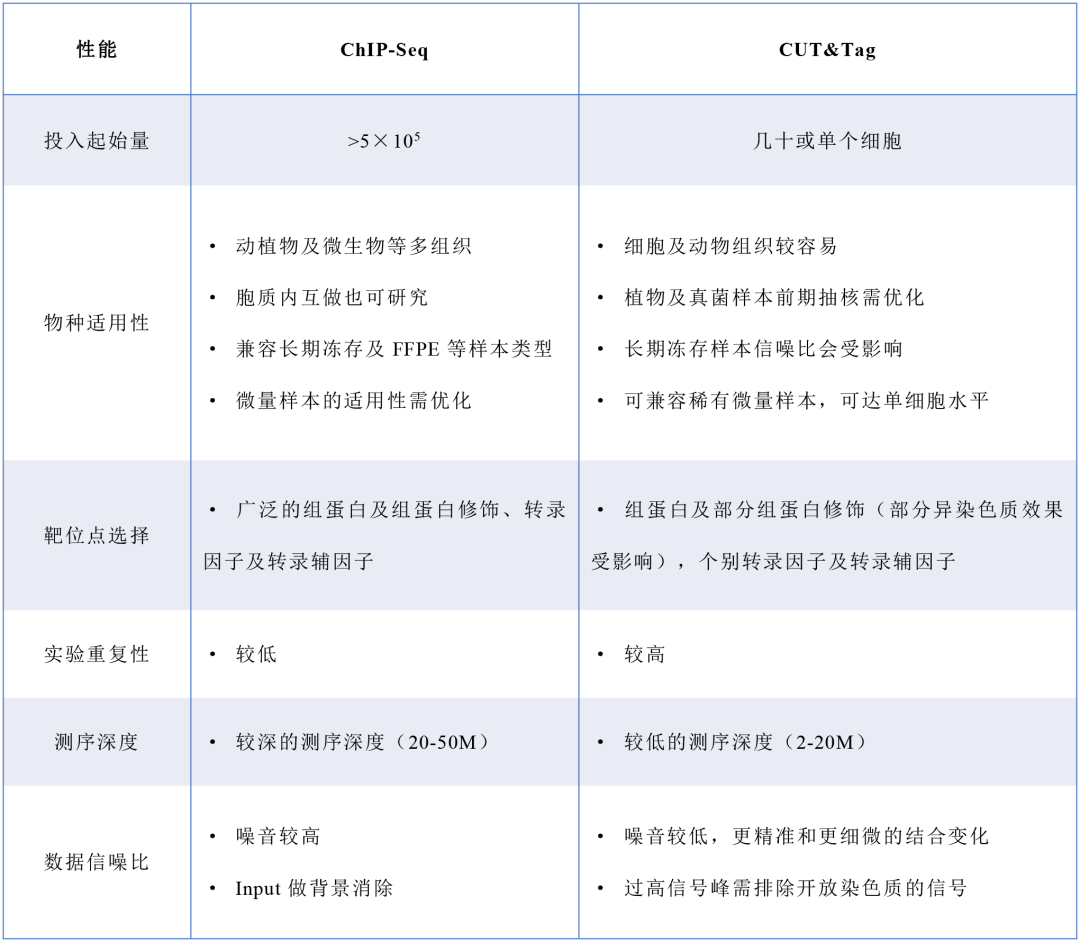
综上,选择ChIP-seq还是CUT&Tag应基于研究的具体的条件和需求,包括实验室条件、时间限制因素、样本类型、细胞数量、靶标选择、数据质量等因素。
基于实验室条件与技术能力:ChIP-seq需要特定的实验仪器,如真空交联仪、超声波打断仪等,而CUT&Tag对硬件的依赖较少,可操作性会大一些。
基于样本类型与细胞数量考虑,如果研究涉及稀有细胞类型或难以获取大量细胞的样本,CUT&Tag的低细胞量需求将是优先选择,而对于不那么受限于样本量的研究,ChIP-seq仍然是可行的选择。
基于研究的靶标选择:若研究的目标蛋白有高质量的ChIP级抗体可用,且对交联固定的步骤没有特殊顾虑,ChIP-seq可以是可靠的方法。反之,若抗体资源有限或需避免交联带来的潜在影响,CUT&Tag提供了一种更为灵活的替代方案。
针对信噪比和精确度,在关注低丰度信号或精细定位的研究,CUT&Tag以其高效的信号提取和较低背景噪音成为优选。而如果研究允许一定程度的背景信号,并重视广泛的覆盖度,ChIP-seq可能也能满足需求。
总之,ChIP-seq和CUT&Tag各有千秋也也互为补充,在特定研究情境下灵活运用ChIP-seq与CUT&Tag这两种强大的工具,不仅能够提高研究效率,降低成本,还能确保数据的准确性和可靠性,能够极大促进我们对基因调控、表观遗传学及细胞功能等领域的理解。
CUT&Tag产品介绍
CUT&Tag是研究蛋白和DNA互作的新兴实验方法,该方法是通过蛋白特异性抗体引导Protein A-Tn5酶在目标蛋白结合的DNA位置进行切割并且在序列两端加上测序接头,经过PCR扩增后形成可以用于高通量测序的文库,随后对文库进行测序分析从而解析与目标蛋白结合的DNA片段。
产品优势:
1. 无需甲醛交联,样本要求量低,背景干净,可重复性好;
2. 提供从方案设计,建库测序,到数据分析和验证一站式服务;
3. 云平台,多组学联合分析深度挖掘数据;
4. 项目经验丰富:
实测数据:
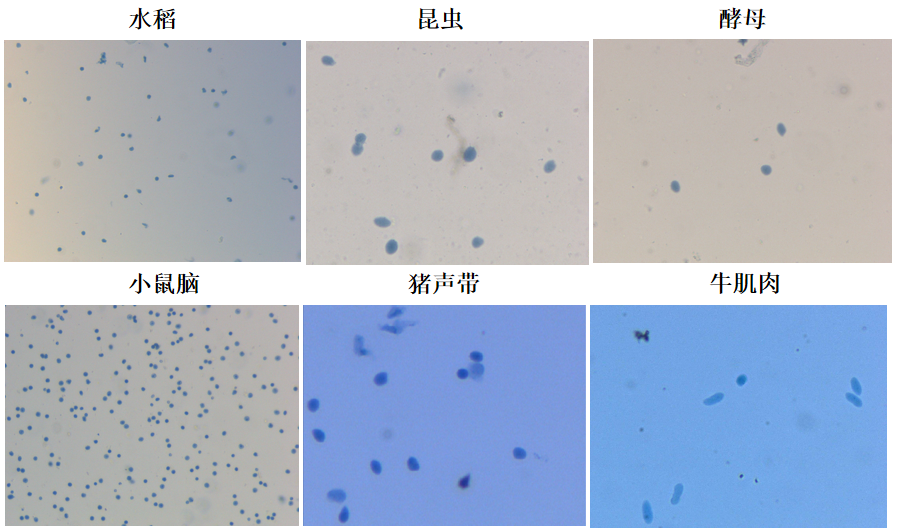
1. 抽核结果
提供“单细胞测序”标准的抽核解决方案。
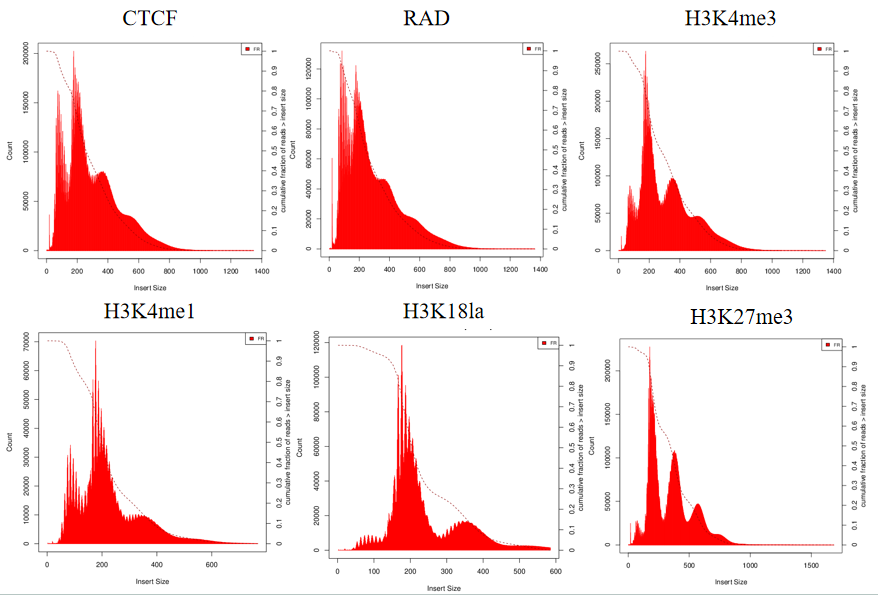
2. CUT&Tag酶切片段分布
转录因子/组蛋白修饰的酶切片段分布呈现周期性。
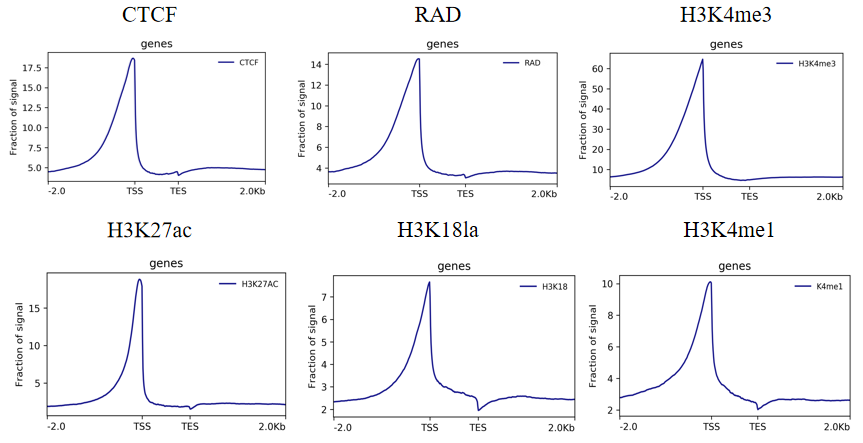
3.reads密度分布图
reads在TSS附近呈现明显的富集。
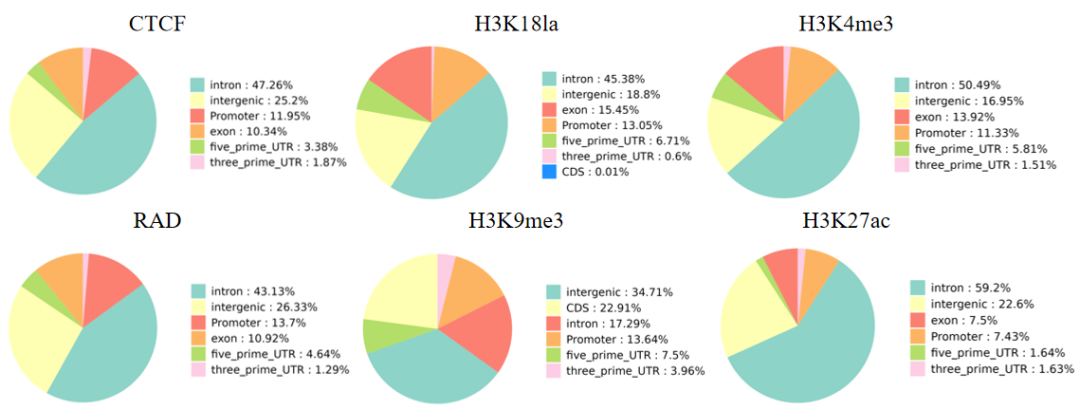
4.功能元件分布图
Peak在基因功能元件上分布。
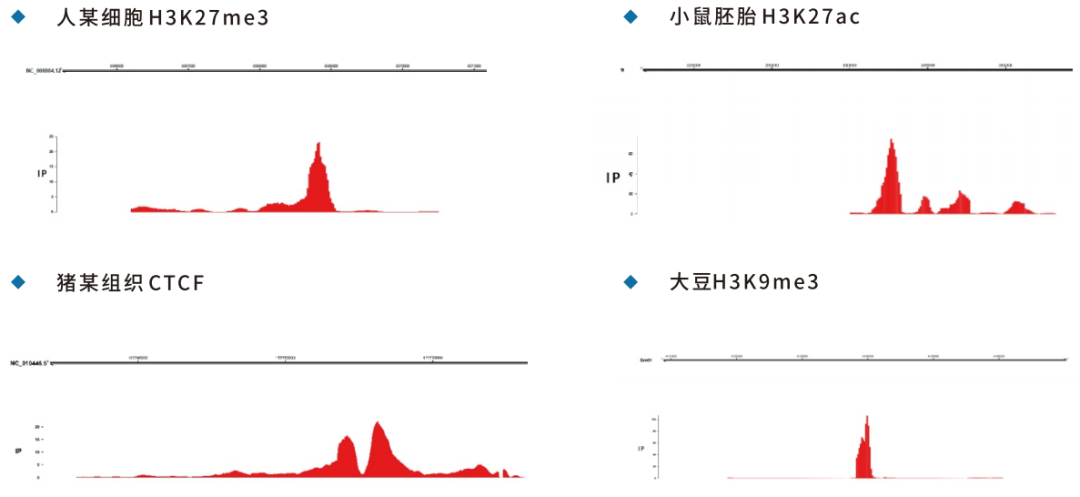
5.Peak可视化
ChIP-seq 产品介绍
ChIP-seq技术将染色质免疫共沉淀和二代测序技术结合,是研究体内蛋白质与DNA相互作用的有力工具,可用于组蛋白修饰、RNA聚合酶、转录因子和辅因子以及G4链体(G4)等方面的研究,技术成熟稳定。爱基百客ChIP-seq可提供:
ChIP-seq测序分析
1. Peak分析: Peak注释和分布分析,Peak关联基因的GO、KEGG的注释和富集分析, 转录因子和Motif分析等。
2. 多样本差异分析:差异 Peak 分布情况统计,差异 Peak 关联基因GO、KEGG 功能注释与富集,转录因子预测,Motif 预测等。
后续验证
1. ChIP-qPCR
分析组蛋白修饰/转录因子与染色质区域的结合情况,揭示染色质状态和基因表达调控之间的关系,真实反映结合特性。02 EMSA基于DNA-蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中的迁移率不同,检测活化的与DNA结合的蛋白转录或调节因子。03 双荧光素酶报告实验检测转录因子与靶启动子的特异结合。
2. ChIP-seq+转录组关联分析
ChIP-seq和转录组关联分析可以做以下2个方面的研究:1、DNA结合蛋白和基因表达调控:通过ChIP-seq技术可以确定DNA结合蛋白(如转录因子)的结合位点,然后与转录组数据结合分析,可以获得转录因子直接调控的靶基因,为全面理解转录因子调控功能提供依据。2、组蛋白修饰和基因表达:ChIP-seq可以用于鉴定组蛋白修饰的位点,结合转录组数据可以了解这些修饰对基因表达的影响。
技术优势:
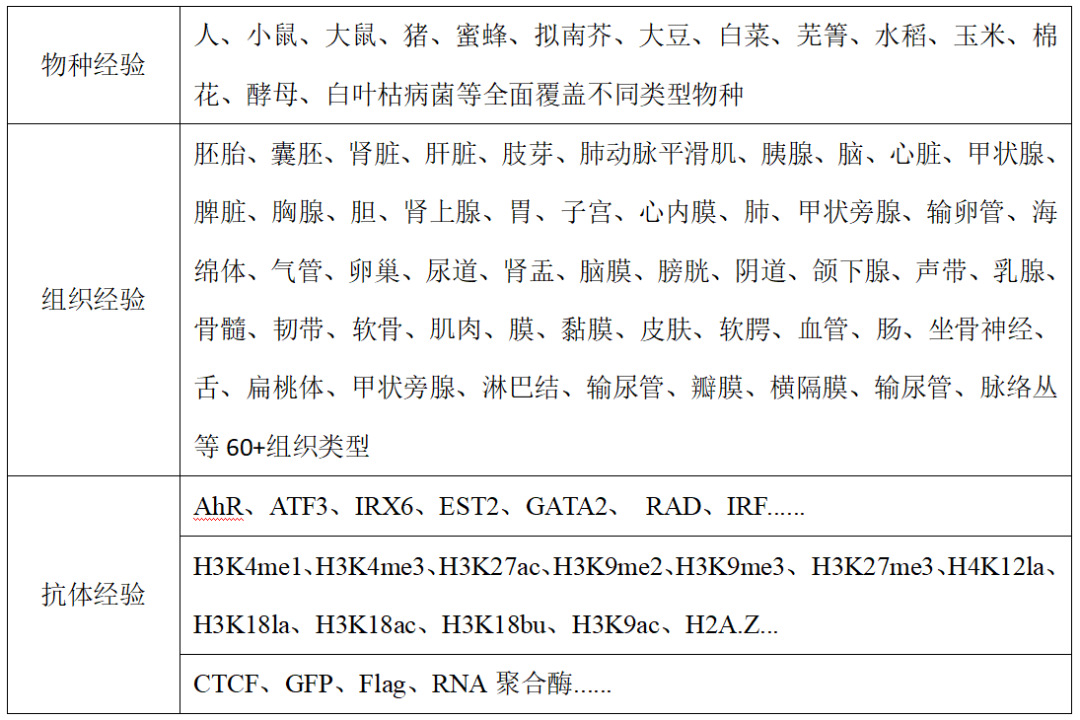
1. 项目经验丰富,研究物种200+种,累计实验2000余次。全面覆盖医口和农口等不同样本,不惧特殊样本(如脂肪组织、高淀粉组织和真菌类),抗体经验也极其丰富(多种组蛋白修饰、转录因子、标签抗体以及p300和RNApol II等均有涉及);
2. 提供前期实验设计、测序、分析以及后期验证(ChIP-qPCR、EMSA)一站式服务;
3. 项目文章多次发表于Cancer Cell、Circulation、Nature Plants、Nature Metabolism以及Plant Cell等期刊。